Excitovaný stav
IONIZACE
EXCITOVANÝ STAV
Pojmem ionizace se rozumí situace, kdy se k atomu poutají nebo naopak odštěpují elektrony; vznikají tak kationty (ztráta elektronu, kladný náboj) a anionty (příjem elektronu, záporný náboj). Pro vlastní ionizaci je třeba ionizační energie, tj. energie nutná k tomu, aby se z atomu odštěpil elektron. Při přijetí elektronu se energie uvolňuje, její množství je charakterizováno pojmem elektronová afinita.
Excitovaný stav
Některé atomy, jejichž elektrony se v orbitalech vyskytují ve dvojicích, mají nízkou vaznost. Existencí tzv. vakantních orbitalů (→ orbitalů, jenž neobsahují elektrony, mají však stejné n jako zaplňené orbitaly) a dodáním energie lze vaznost zvětšit tím, že elektron vystoupí na vyšší energetickou hladinu (! stejné n, vyšší l). To dovoluje atomu poskytnout více nepárových elektronů a tím i větší vaznost. Excitovaný stav atomu zapisujeme ZA*: Z je protonové číslo, A je prvek v excitovaném stavu, hvězdička značí, že elektronový obal je v excitovaném, tj. ne základním stavu. Poznámka: excitují se nejprve elektronové páry s nejvyšším l, následně s nižším.
Tvorba excitovaných stavů
| l = 1 | l = 2 | l = 3 | l = 4 |
| s | s | s | s |
| / | p | p | p |
| / | / | d | d |
| / | / | / | f |
K tabulce: je zde vypsána z toho důvodu,
aby si čtenáři mohli rychle najít, pro která l náleží které orbitaly
a snadněji tak určili, zda je možno některý z nich „použít“ jako vakantní.
1. pokud následující orbital neobsahuje elektronové páry
a není zcela zaplněn elektrony téhož spinu
pokud orbital s vyšším l neobsahuje elektronové páry a není zcela zaplněn elektrony téhož spinu (např. 2s2 2p2), lze elektronový pár v energeticky chudším orbitalu rozbít a jeden z elektronů umístit do následujícího orbitalu (→ 2s1 2p3)
příklady:
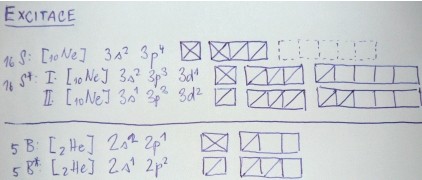
14Si: [10Ne] 3s2 3p2 → 14Si*: [10Ne] 3s1 3p3
5B: [2He] 2s2 2p1 → 5B: [2He] 2s1 2p2
2. pokud následující orbital je vakantní
v takovém případě se buď rozbíjejí elektronové páry uvnitř orbitalu, nebo se rozbíjí elektronový pár s ještě nižším l
příklady:
15P: [10Ne] 3s2 3p3 → 15P*: [10Ne] 3s1 3p3 3d1
17Cl: [10Ne] 3s2 3p5 → 17Cl*: [10Ne] 3s2 3p4 3d1
excitované stavy lze tvořit tak dlouho, dokud:
není vakantní orbital zcela zaplněn nepárovými elektrony
je možno odkud brát nepárové elektrony (→ dokud všechny elektronové páry v předchozích orbitalech nejsou rozděleny)
Obrázek - Excitovaný stav "na papíře"