Hybridní stav
(hybridizace)
Hybridní stav je odvozen od energetického stavu centrálního atomu molekuly – základního nebo excitovaného. Hybridizaci podstupují pouze vazebné elektrony, které se účastní vazeb sigma (tj. vazeb jednoduchých).
Zápis hybridizace
– zápisem hybridizace se rozumí vypsání valenčních elektronů centrálního atomu v orbitalech a určení energetického stavu atomu
– zápis se tedy podobá zápisu stavu elektronového obalu, pouze se změnami, které způsobují elektrony podílející se na pí vazbě
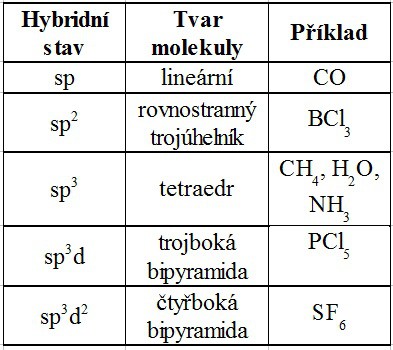
Druhy hybridních stavů
– druhy hybridních stavů se odvozují podle toho, které orbitaly se podílejí na chemické vazbě, popř. podle volných elektronových párů
– dle druhu hybridního stavu lze určit tvar molekuly
Příklad: Určete hybridní stav a tvar molekuly kyseliny sírové H2SO4.
Postup řešení:
1. Centrální atom a jeho základní a excitovaný stav podle počtu vazeb.
centrální atom: síra SVI
vazebné elektrony: 6 (ox. č. VI)
pí a sigma vazby: určujeme podle toho, kolik je k centrálnímu atomu poutaných atomů kyslíků dvojnou vazbou – tj. 2 (2 jsou poutány jednoduchou vazbou, protože ještě poutají atom vodíku) => 2 elektrony z elektronového zápisu vyřadíme
základní stav centrálního atomu: 16S: [10Ne] 3s2 3p4
excitovaný stav centrálního atomu: 16S*: II. [10Ne] 3s1 3p3 3d2 (II. excit. stav dovoluje vytvořit 6 chemických vazeb)
2. Hybridizace
– určení hybridního stavu se nyní provede určením, které elektrony v jakých orbitalech se budou účastnit hybridizace
=> 2 pí vazby → škrtají se 2 elektrony s nejvyšší energií: 3s1 3p3 3d2
=> zbývá 3s1 3p3 → sp3, odpovídá tetraedru
Poznámka:
sigma vazba je vazba, která vzniká překryvem valenčních orbitalů na spojnici jader atomů, na této spojnici je tedy největší elektronová hustota; vzniká překryvem dvou orbitalů s nebo orbitalu s a p, popř. dvou orbitalů p ležících na jedné ose
pí vazba je vazba, která vzniká překryvem valenčních orbitalů mimo spojnici atomových jader, tj. orbitalů p ležících na dvou nebo třech osách, elektronová hustota je nejvyšší mimo tuto spojnici
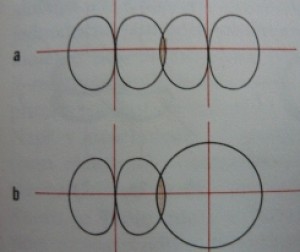
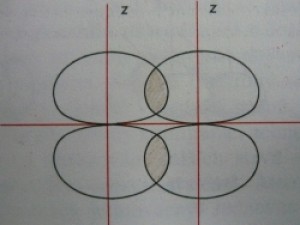
------
nahoře - a) schéma sigma vazby vznikající překryvem dvou p orbitalů; b) schéma sigma vazby vznikající překryvem s a p orbitalu
dole - schéma pí vazby vznikající překryvem dvou pí orbitalů
Obrázky: Chemie / Obecná a anorganická, SPN